Es ist notwendig, die Stoffwechselwege der Carnosin-Umwandlung im Organismus zu klären, um die biologische Bedeutung dieser Verbindung zu verstehen. Die Abwesenheit von Carnosin im Urin unter moderatem Training (Hunter, 1925) legt nahe, dass normalerweise nicht modifiziertes Carnosin nicht aus dem menschlichen Körper ausgeschieden wird, sondern vor der Ausscheidung einem metabolischen Abbau unterliegt.
Es war im Jahr 1915, dass Ditrich zeigte, dass weder Pepsin noch Trypsin das Carnosin-Molekül verdauen. Daher war es wichtig herauszufinden, welches Enzym für die Hydrolyse von Carnosin verantwortlich ist.
Skelettmuskeln sind das Hauptdepot von Carnosin und Anserin. Daher war es ganz natürlich zu erwarten, dass die metabolische Umwandlung dieser Dipeptide mit vitalen Aktivitäten von Muskelzellen verbunden ist.
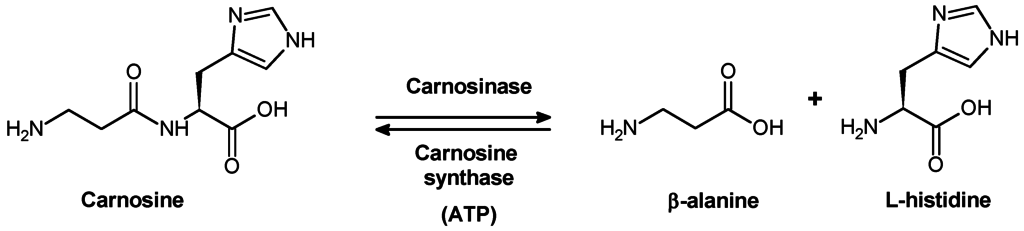
Meshkowa und Zolotarewskaja haben beschlossen, dass carnosina in den Muskelgeweben weder die autolytische Umwandlung noch durch die Muskelfermente hydrolysiert (Meshkowa, Zolotarewskaja, 1937). Es wurde im Labor von S.E. Severin festgestellt, dass Nieren, Leber, Milz und Erythrozyten ein Enzym enthalten, das die Hydrolyse von Carnosin katalysieren kann (Гаркави, 1938, 1940; Северин, Георгиевска, 1938). Garkavi (Гаркави, 1938) vermutete auf Grund der strukturellen Eigenschaften dieses Enzyms, dass es Carboxypolypeptidase ist. Ein Enzym, das in der Lage ist, Carnosin zu hydrolysieren, wurde 1949 aus der Schweineniere isoliert (Hanson und Smith, 1949). Manganionen und Cyanide oder Sulfide verursachten Aktivierung bzw. Hemmung der Aktivität des Enzyms. Zusätzlich zu Carnosin katalysierte dieses Enzym die Hydrolyse einiger anderer Dipeptide, jedoch in viel langsamerer Geschwindigkeit.
Als die Nierenkarnosinase der Schweine zum ersten Mal schlecht gereinigt wurde, wurde herausgefunden, dass dieses Enzym in Abwesenheit von Metallionen stark substratspezifisch ist, da es Carnosin und Anserin anstelle von Homocarnosin hydrolysiert. In Gegenwart von Co2 + verliert Carnosinase die Substratspezifität und katalysiert die Hydrolyse von Homocarnosin und vielen anderen Dipeptiden (Lenney, 1990). Das Molekulargewicht des Enzyms beträgt 57 kDa; pl 5.5; und Michaelis konstanter Wert (Km) für Carnosin ist niedriger 0,4 mM. Carnosinase ist sehr selektiv zu Carnosin. Da selbst kleine Modifikationen der Dipeptidstruktur eine signifikante Wirkung auf die Aktivität des Enzyms haben, wird Anserin als “schlechtes” Substrat angesehen, während Homocarnosin überhaupt nicht hydrolysiert wird.
Carnosinase ist heterogen über den ganzen Körper und über verschiedene Strukturen des Tiergehirns verteilt. Menschliche Körpergewebe enthalten auch zwei Arten von Dipeptidasen, die in der Lage sind, Carnosin zu hydrolysieren. Diese Enzyme unterscheiden sich wesentlich in der Aktivierung durch Metallionen, Molekulargewicht, Substratspezifität usw.
Eine dieser Enzyme, “Gewebe” -Carnosinase, ist nicht in der Lage, weder Homocarnosin noch Anserin zu hydrolysieren. Das zweite Enzym ist in der Lage, Carnosin, Anserin und in einem geringeren Ausmaß Homocarnosin zu hydrolysieren. Dieses Enzym ist im Blutserum reichlich vorhanden, wo es eine wichtige Rolle bei der Hydrolyse von Carnosin in der Nahrung (“Serum” -Carnosinase) spielt.
Carnosinämie, auch Carnosinase-Mangel genannt, ist eine seltene autosomal-rezessive Stoffwechselstörung, die durch einen Mangel an Carnosinase, einer Dipeptidase (einer Enzymart, die Dipeptide in ihre beiden Aminosäurebestandteile spaltet) verursacht wird. Das Gen für Carnosinase befindet sich auf Chromosom 18, einem Autosom. Das Carnosin-Dipeptidase-1-Gen kontrolliert Gewebe und Serum-CarnKarnoysinase. Mutationen in diesem Gen sind für einen Carnosinase-Mangel verantwortlich, der zu Carnosinämie führt. Ein Mangel an Serum-Carnosinase ist zusammen mit Carnosinurie (“Carnosin im Urin”) der übliche metabolische Indikator für einen systemischen Carnosinase-Mangel. Diese Form der Dipeptidase wird im menschlichen Blut erst in der späten Kindheit gefunden und steigt langsam bis zum Alter von 15 Jahren auf das Erwachsenenalter an. Eine Vielzahl von neurologischen Symptomen wurde mit Carnosinämie in Verbindung gebracht. Dazu gehören: Hypertonie, Entwicklungsverzögerung, mentale Retardierung, Degeneration von Axonen, sensorische Neuropathie, Zittern, Demyelinisierung, Anomalien der grauen Substanz und myoklonische Anfälle.
